Cet article a été publié dans Découvrez numéro annuel sur l’état de la science sous le titre «CRISPR Gets Under the Skin». Soutenez notre journalisme scientifique en devenant un abonné.
Pour la première fois, des scientifiques ont injecté l’outil d’édition de gène CRISPR-Cas9 à un patient humain dans le cadre d’un essai clinique. Il marque une autre étape importante pour l’édition des gènes humains et une étape vers l’introduction des thérapies géniques à des populations de patients plus larges.
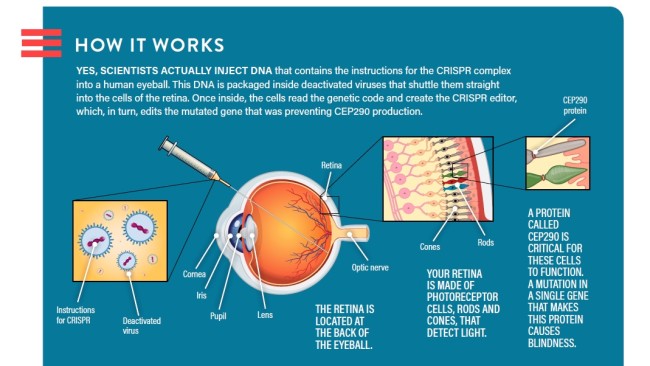
Les sociétés pharmaceutiques Allergan et Editas Medicine se sont associées à l’Oregon Health & Science University pour l’essai, nommé BRILLIANCE, qui vise à traiter une forme de maladie oculaire congénitale connue sous le nom de LCA10. Dans l’essai, les scientifiques injectent des instructions pour l’éditeur de gène CRISPR, encapsulé dans la coquille d’un virus désactivé, dans les yeux des patients. Là, si tout se passe bien, l’outil va découper un gène problématique et restaurer leur vision.
Bien que CRISPR ait été utilisé dans le passé pour traiter des patients, ces essais impliquaient de retirer des cellules du corps, de les éditer en laboratoire, puis de les remettre dans les humains. Ce nouveau travail est la première fois que CRISPR-Cas9 a été injecté directement dans le patient. Pourtant, ce n’est pas la première fois qu’un éditeur de gènes est mis au travail chez un humain – cette distinction va à un autre outil d’édition de gènes appelé nucléase à doigt de zinc, qui a été testé en 2017 chez un homme atteint du syndrome de Hunter, une maladie génétique héréditaire. .
Mais cet essai clinique de 2020 est un jalon pour CRISPR-Cas9, qui a révolutionné la recherche sur l’édition de gènes depuis sa découverte en 2012.
«Nous pensons vraiment que c’est une technologie qui peut faire une énorme différence dans le monde et chez de nombreux patients», déclare Mark Pennesi, professeur agrégé d’ophtalmologie au Casey Eye Institute de l’OHSU et chercheur principal de l’étude. L’essai attirera certainement un examen minutieux de la part de l’industrie pharmaceutique, des organismes de réglementation gouvernementaux et d’autres scientifiques. Mais Pennesi espère qu’en cas de succès, il pourrait ouvrir la voie à de futures études utilisant CRISPR dans le corps pour traiter un large éventail de maladies.
(Crédit: Jay Smith)
Il existe de nombreuses maladies rares, comme LCA10, qui sont causées par une mutation d’un seul gène. Les éditeurs de gènes sont des options de premier ordre pour guérir ces maladies, qui vont de la drépanocytose à la maladie de Huntington et à des centaines d’autres conditions graves.
Dans le cas de LCA10, les mutations d’un gène connu sous le nom de CEP290 agissent comme une sorte de signe d’arrêt, arrêtant la production d’une protéine nécessaire au fonctionnement des photorécepteurs dans l’œil. Le résultat est que les patients atteints de la maladie sont souvent légalement aveugles au moment où ils atteignent l’âge adulte.
Le traitement CRISPR supprimera le gène du signe d’arrêt muté et permettra au corps de commencer à fabriquer la protéine photoréceptrice cruciale. La question de savoir si ce processus fonctionne pour réparer les dommages causés par LCA10 est l’une des facettes de l’essai; une autre est de savoir si la procédure sera sûre.
Les éditeurs de gènes CRISPR courent le risque de ce qu’on appelle des effets hors cible, qui se produisent lorsque l’outil coupe par erreur un gène qu’il n’est pas censé faire. De nouvelles et meilleures versions de l’outil ont réduit le taux de telles erreurs, mais elles restent préoccupantes. Pourtant, dit David Segal, généticien au Genome Center de l’Université de Californie à Davis, qui n’est pas impliqué dans la recherche, les résultats préliminaires de l’essai sont prometteurs et il pense que le traitement pourrait présenter de réels avantages pour les patients.
«C’est vraiment excitant de voir les choses arriver à ce niveau», dit Segal.